Molekulare Präzisionsmedizin bei Autoimmunität
Autoimmunerkrankungen wie die rheumatoide Arthritis (RA) und der systemische Lupus erythematodes (SLE) entstehen durch fehlgeleitete Immunreaktionen gegen Autoantigene und äußern sich in einer Vielzahl von pathologischen Zuständen mit hoher sozioökonomischer Belastung.
Im Heinz-Labor kombinieren wir die klassische Biochemie mit modernen „Omics“-Ansätzen, um die molekularen Mechanismen zu entschlüsseln, die diese Autoimmunerkrankungen charakterisieren und antreiben. Das detaillierte Verständnis der zugrundeliegenden Pathomechanismen ist der Schlüssel zur Identifizierung neuer Zielmoleküle und informativer Biomarker, die eine patientenspezifische Präzisionsmedizin ermöglichen.
Schwerpunkt I: Signalwege des angeborenen Immunsystems als Treiber der Autoimmunität.
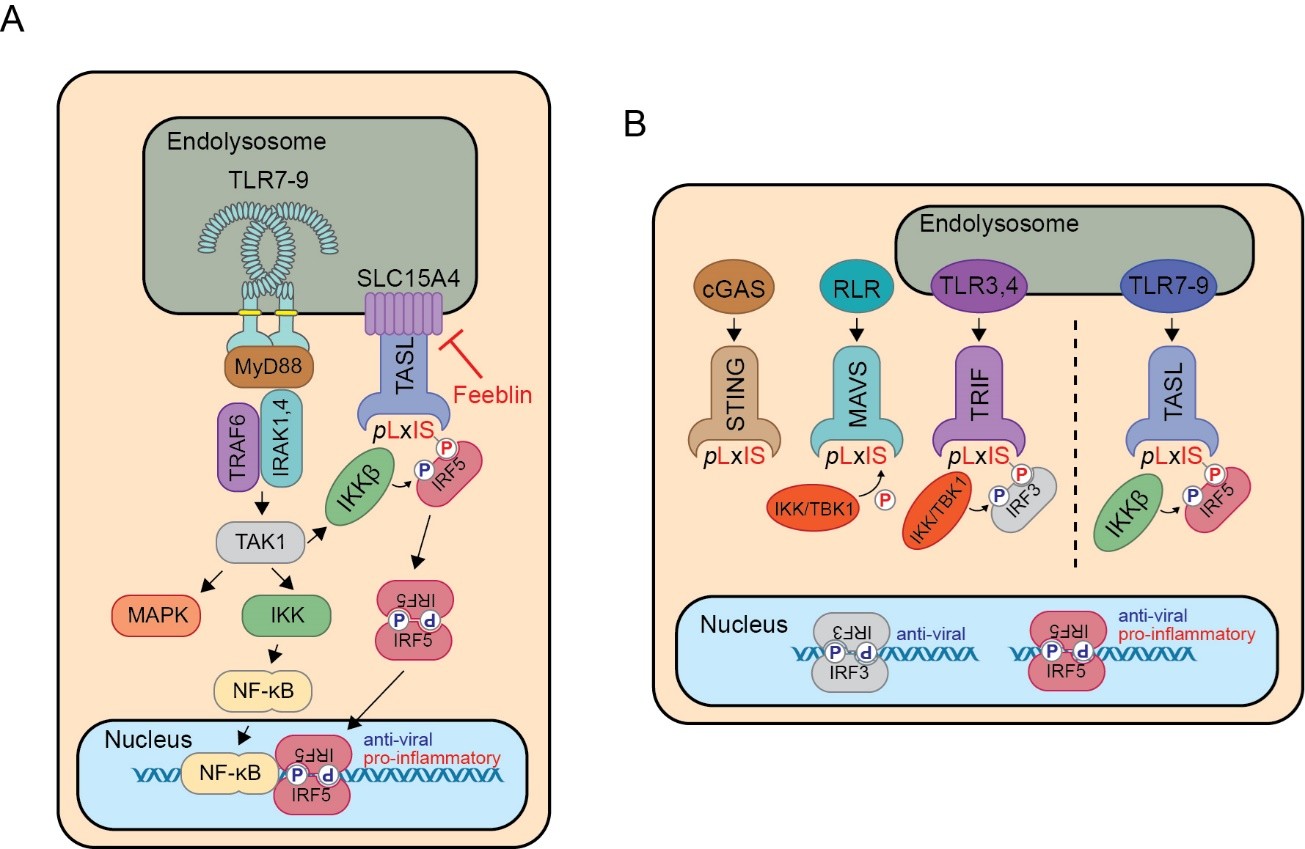
Ein Hauptaugenmerk des Labors liegt auf dem SLC15A4/TASL-Adapterkomplex, der die Nukleinsäure-sensierenden endosomalen Toll-like-Rezeptor 7/8/9-Signalwege zur IRF5-Aktivierung weiterleitet (Heinz et al., Nature, 2020; Abbildung 1). Die starke genetische und funktionelle Verbindung des SLC15A4/TASL/IRF5-Moduls mit der Autoimmunität und die kürzlich nachgewiesene Möglichkeit der Hemmung durch erstklassige kleine Moleküle (Boeszoermenyi et al., Nat. Commun., 2023) machen es zu einem vorrangigen Ziel für weitere Untersuchungen bei Patienten.
Figure 1 – (A) Schematische Darstellung des SLC15A4/TASL-Adaptermoduls bei der endosomalen TLR-induzierten IRF5-Aktivierung. (B) Vergleich der IRF3-Adapter STING, MAVS und TRIF mit der SLC15A4/TASL-induzierten IRF5-Aktivierung.
Schwerpunkt II: Phänotypische Patientenstratifizierung durch Hochkontrastmikroskopie.
Die Phänotypisierung von PBMCs von RA-Patienten mittels Hochkontrastmikroskopie wurde bereits erfolgreich für Ex-vivo-Medikamententests und zur Patientenstratifizierung eingesetzt (Abbildung 2, Kartnig et al., eBioMedicine, 2025). Dieses Instrument für die funktionelle Präzisionsmedizin wird derzeit weiterentwickelt und getestet, u. a. in innovativen Co-Kultur-Modellen, die Fibroblasten-ähnliche Synoviozyten (FLS) enthalten.
Schwerpunkt III: Strukturelle Immunologie.
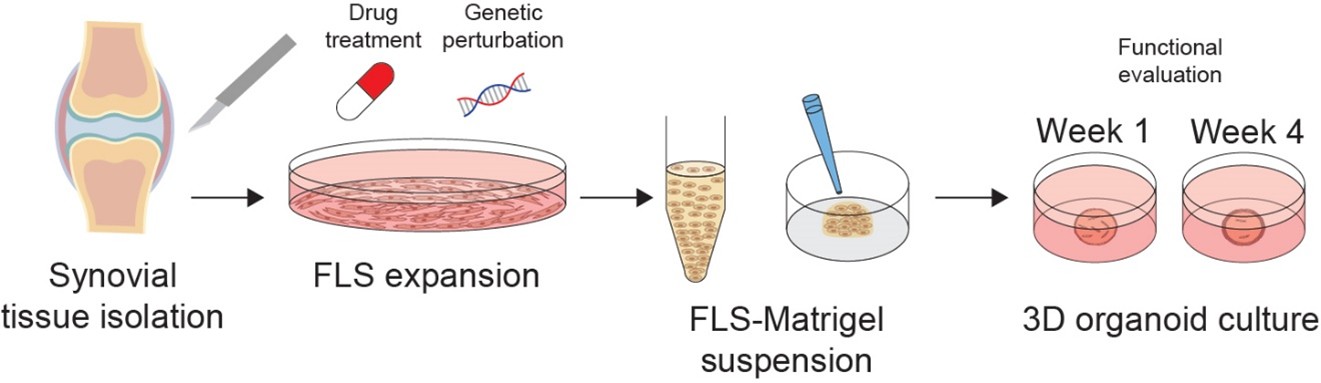
Fibroblastenähnliche Synoviozyten (FLS) sind die Hauptursache für die rheumatoide Arthritis (RA), doch es gibt keine Therapeutika, die speziell auf diese Zellen abzielen. In enger Zusammenarbeit mit den experimentellen Gruppen unserer Abteilung wollen wir funktionelle Ansätze anwenden, um die Mechanismen der Krankheit aufzuklären. Synovialbiopsie-basierte innovative 2D- und 3D-Synovialorgan-Kulturen werden eingesetzt, um die funktionelle Bewertung mit CRISPR/Cas9-basierten Ansätzen und Medikamententests zu erleichtern (Figure 3).
Figure 3
Aktuelle Mitglieder
Stand Juli 2025.
Wichtigste Publikationen
1. Kartnig, F. et al. Ex vivo imaging-based high content phenotyping of patients with rheumatoid arthritis. EBioMedicine 111, 105522 (2025). https://doi.org/10.1016/j.ebiom.2024.105522.
2. Boeszoermenyi, A. et al. A conformation-locking inhibitor of SLC15A4 with TASL proteostatic anti-inflammatory activity. Nat Commun 14, 6626 (2023). https://doi.org/10.1038/s41467-023-42070-3.
3. Mrak, D. et al. Heterologous vector versus homologous mRNA COVID-19 booster vaccination in non-seroconverted immunosuppressed patients: a randomized controlled trial. Nat Commun 13, 5362 (2022). https://doi.org/10.1038/s41467-022-33036-y.
4. Heinz, L. X. et al. TASL is the SLC15A4-associated adaptor for IRF5 activation by TLR7–9. Nature 581, 316–322 (2020). https://doi.org/10.1038/s41586-020-2282-0.
5. Heinz, L. X. et al. The Lipid-Modifying Enzyme SMPDL3B Negatively Regulates Innate Immunity. Cell Rep 11, 1919–1928 (2015). https://doi.org/10.1016/j.celrep.2015.05.006.
6. Köberlin, M. S. et al. A Conserved Circular Network of Coregulated Lipids Modulates Innate Immune Responses. Cell 162, 170–183 (2015). https://doi.org/10.1016/j.cell.2015.05.051.