Rheumatische Erkrankungen des Bewegungsapparats sind weltweit die Hauptursache für Schmerzen und Behinderungen.
Die häufigste entzündliche, erosive Gelenkerkrankung ist die rheumatoide Arthritis (RA). Eine chronische Gelenkentzündung führt zu irreversiblen strukturellen Gelenkschäden, wenn die Krankheit unbehandelt bleibt oder nicht ausreichend auf die verfügbaren therapeutischen Strategien anspricht.
Unsere wissenschaftliche Forschung konzentriert sich auf die Identifizierung neuer Pathomechanismen und Targets, die zu entzündungsbedingten Knochen- und Knorpelschäden beitragen. Unser Ziel ist es, mehr Einblicke in die lokale Bildung von synovialen Osteoklasten zu gewinnen, dem wichtigsten Zelltyp, der für das Auftreten von Knochenerosionen verantwortlich ist. Insbesondere untersuchen wir den Zusammenhang zwischen einem dysregulierten Immunsystem (proinflammatorische Zytokine, Signalwege) und Veränderungen des Skelettsystems. Unsere Forschung befasst sich auch mit der gestörten Osteoblastenfunktion unter Entzündungsbedingungen sowie mit der Rolle aktivierter synovialer Fibroblasten bei der Gelenkzerstörung.
Um die Wege der entzündungsvermittelten strukturellen Gelenkschäden zu erforschen, untersuchen wir verschiedene In-vivo-Modelle der RA, wobei wir sowohl Knockouts mit Funktionsgewinn als auch therapeutische Strategien einsetzen. Zu den wichtigsten Ergebnismessungen gehören klinische Symptome, µCT-Knochenanalysen, histopathologische Analysen sowie In-vitro-Zellfunktionstests (Osteoklasten, Osteoblasten, Fibroblasten, Chondrozyten).
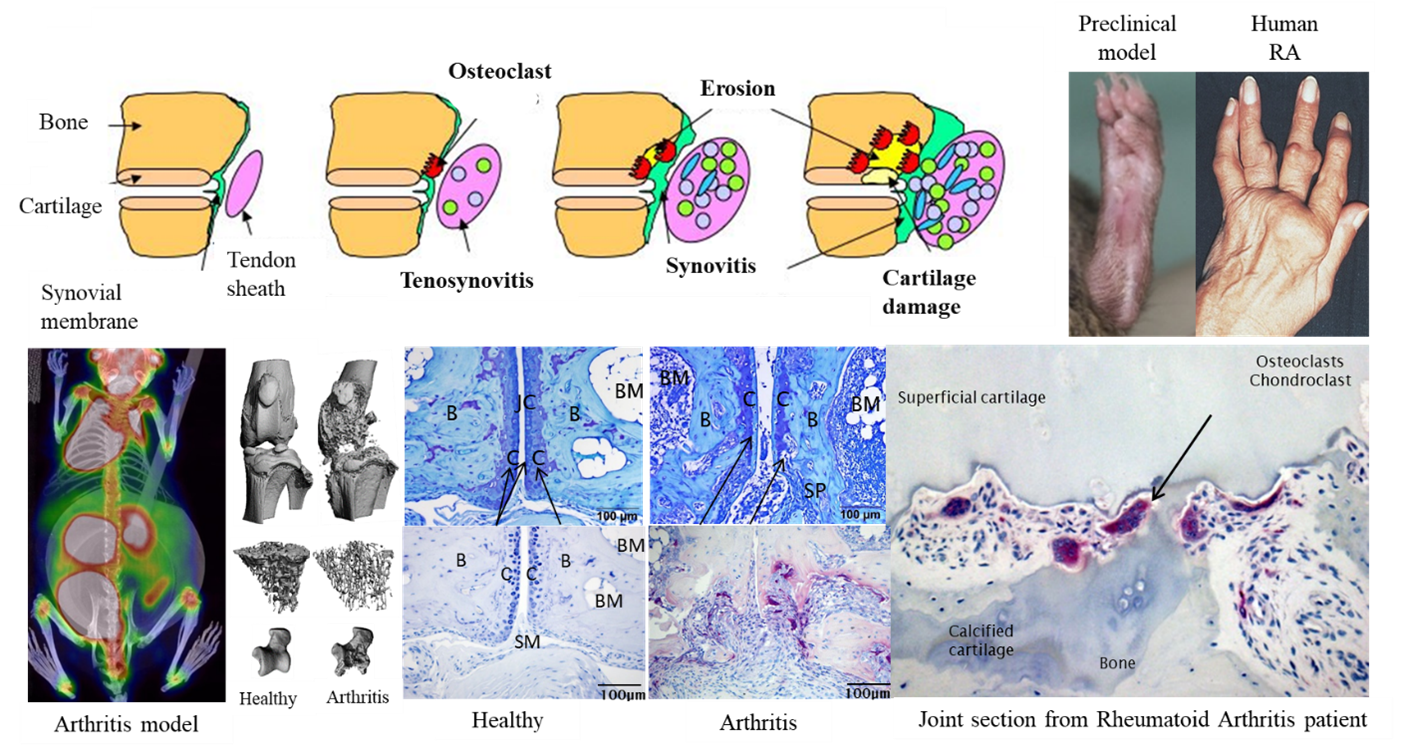
Bilder: Entwicklung einer chronisch-entzündlichen, erosiven Arthritis. Obere Reihe: Schematische Darstellung der Entwicklung der RA. Klinische Anzeichen von geschwollenen und deformierten Gelenken in einem präklinischen Modell und bei einem RA-Patienten (rechts). Untere Reihe (von links nach rechts): [18F]PET/CT-Aufnahme einer arthritischen Maus, µCT-Knochenaufnahmen von gesunden und arthritischen Mäuseknien, trabekulärer Knochenverlust und Schädigung des Talusknochens; mit Toluidinblau gefärbter Schnitt, der auf Knorpelschäden hinweist, mit Tartrat-resistenter saurer Phosphatase gefärbter Schnitt, der Osteoklasten und subchondrale Knochenerosion in einem experimentellen Mausmodell anzeigt. Rechts: Histologischer Schnitt bei menschlicher RA, der Osteoklasten und subchondrale Gelenkschäden anzeigt.
Aktuelle Mitglieder
Stand Jänner 2024.

Publikationen Highlights
'SMASH' recommendations for standardised microscopic arthritis scoring of histological sections from inflammatory arthritis animal models.
Dieses Manuskript enthält internationale Empfehlungen zur standardisierten Bewertung histopathologischer Merkmale in präklinischen Modellen für entzündliche, erosive Arthritis.
Multimodal [18 F]FDG PET/CT Is a Direct Readout for Inflammatory Bone Repair: A Longitudinal Study in TNFα Transgenic Mice.
In dieser Studie haben wir die in vivo [18F]FDG-PET/CT-Bildgebung eingesetzt, um das Fortschreiten der Krankheit und das Ansprechen auf die Behandlung in einem experimentellen Arthritis-Mausmodell zu überwachen, was auf die Reversibilität von Gelenkentzündungen und Knochenschäden hinweist.
Tenosynovitis and osteoclast formation as the initial preclinical changes in a murine model of inflammatory arthritis.
Die Verwendung von Tiermodellen ermöglichte es uns, erste präklinische und sehr frühe histopathologische Ereignisse bei entzündlicher Arthritis zu verstehen und zu identifizieren - eine Krankheitsphase, die bei menschlichen Patienten nicht zugänglich ist.
Kollaborationen
- Wir sind Mitglied des Ludwig-Boltzmann-Instituts für Arthritis und Rehabilitation (LBIAR) und erforschen die Rolle der Glykobiologie in experimentellen Modellen der Osteoarthritis: https://ar.lbg.ac.at/
- Unser Team ist Teil des bilateralen österreichisch-ungarischen Forschungsprojekts (österreichischer FWF - ungarisches NKFIH, Projekt I5608) und arbeitet mit der Gruppe von Tamas Nemeth, MD PhD (Semmelweis Universität, Budapest, Ungarn) und Ulrike Steffen (Uniklinikum Erlangen, Deutschland) zusammen, um die Rolle von Dectin-2 bei immunkomplexvermittelten Entzündungen zu untersuchen.
- Wir arbeiten mit mehreren Kollegen der Medizinischen Universität Wien (Stefan Tögel & Mario Rothbauer/Orthopädie; Erwin Wagner & Latifa Bakiri/Dermatologie, Kazuhiko Matsuoka/Zentrum für Krebsforschung; Bruno Podesser & Attila Kiss/Zentrum für Biomedizinische Forschung und Translationale Chirurgie) und der Veterinärmedizinischen Universität Wien (Richard Moriggl/ The Functional Cancer Genomics laboratory) zusammen
Externe Fördermittel
Unsere Forschung wird durch den Österreichischen Wissenschaftsfonds (FWF), die Österreichische Gesellschaft für Rheumatologie (ÖGR) sowie durch Industriepartner (MedTec, ElliLilly und Abbvie) gefördert.
Kommen Sie in unser Team!
Kommen Sie zu uns! Masterstudenten der Biowissenschaften: Wenden Sie sich an silvia.hayer@meduniwien.ac.at mit einem Lebenslauf und einer Absichtserklärung, in der Sie angeben, warum Sie im Labor mitarbeiten möchten.