Fibroblasten sind ubiquitär vorkommende Zellen, die ursprünglich als immunologisch träge Zuschauer beschrieben wurden, die lediglich für die Produktion und den Umbau der extrazellulären Matrix (ECM) verantwortlich sind.
Ihre Rolle bei Gesundheit und Krankheit ist jedoch sehr viel facettenreicher und komplexer. So sind Fibroblasten maßgeblich an der Aufrechterhaltung der gewebespezifischen Immunität beteiligt, indem sie bei Erkennung pathologischer Stimuli lokale Immunreaktionen aktivieren. Nach der Beseitigung des Krankheitserregers sorgen sie für die Beendigung der Entzündung, indem sie ihre Unterstützung für Immunzellen reduzieren und einstellen. Jüngste Forschungsergebnisse zeigen, dass eine unangemessene oder anhaltende Fibroblastenaktivierung die Persistenz der Entzündung fördert, was letztlich zu Gewebeschäden und Organversagen führt. Die Kenntnis der Mechanismen, die der abnormen Aktivierung von Fibroblasten bei chronischen Entzündungskrankheiten zugrunde liegen, wird zur Entwicklung innovativer therapeutischer Ansätze beitragen.
Unser Labor ist besonders an der Pathogenese der rheumatoiden Arthritis (RA) interessiert. RA ist eine chronische Entzündungskrankheit, die hauptsächlich die Gelenke betrifft. Eine abnorme Aktivierung von Fibroblasten-ähnlichen Synoviozyten (FLS), die in der Synovialmembran ansässig sind, ist der Schlüssel für eine anhaltende Aktivierung von Immunzellen (innerhalb der Synovialmembran) und treibt die Zerstörung von Gelenkknorpel und Knochen voran. Durch den Einsatz herkömmlicher biochemischer Tests (z. B. Western Blots, ELISA,...) und fortschrittlicher Sequenzierungstechnologien wollen wir ein besseres Verständnis dafür gewinnen, wie Entzündungs- und Stoffwechselwege zusammenwirken, um die Aktivierung von FLS zu fördern. Darüber hinaus setzen wir innovative bildgebende Verfahren ein, um die Wechselwirkungen zwischen FLS und Immunzellen zu untersuchen und herauszufinden, wie diese pathogenen Wechselwirkungen gezielt eingesetzt werden können, um neue therapeutische Strategien zu entwickeln, die die chronische Entzündung der Synovialis stoppen können.
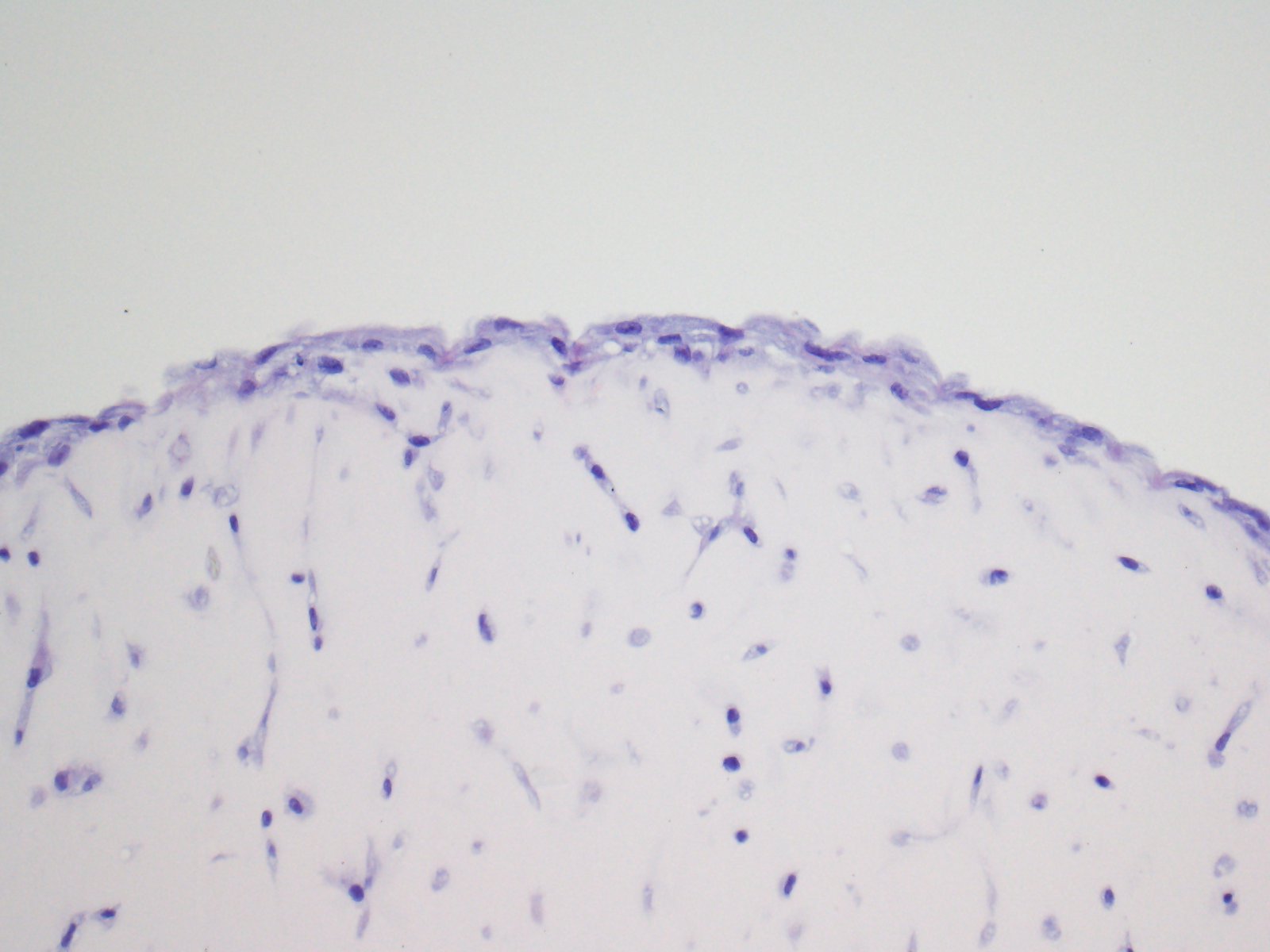

Links ein IHC-Bild, das FLS in einem 3D-Synovialorgan-Kultursystem zeigt. Rechts ein IF-Bild, das FLS-T-Zell-Interaktionen in vitro zeigt.
Publikationen Highlights
Cytokine-directed cellular cross-talk imprints synovial pathotypes in rheumatoid arthritis.
In dieser Studie charakterisieren wir die Interaktionen zwischen T-Zellen und FLS im Kontext von RA mit Hilfe einer High-Content-Imaging-Plattform. Darüber hinaus zeigen wir, wie verschiedene entzündliche Zytokine diese Interaktionen spezifisch beeinflussen, und übertragen unsere In-vitro-Ergebnisse auf klinisch relevante synoviale Pathotypen der RA.
/!\ Sehen Sie sich unser spezielles Video unter diesem Link an.
TNFR2 is critical for TNF-induced rheumatoid arthritis fibroblast-like synoviocyte inflammation.
Unsere Arbeit hier zeigt die entscheidende Rolle des TNF-Rezeptors 2 (TNFR2, TNFRSF1B) bei der Aktivierung des FLS im Zusammenhang mit rheumatoider Arthritis.
IRF1 is critical for the TNF-driven interferon response in rheumatoid fibroblast-like synoviocytes.
In dieser Arbeit weisen wir dem Transkriptionsfaktor IRF1 eine Rolle bei der TNF-induzierten Aktivierung von RA-FLS zu. Außerdem beschreiben wir eine TNF-IRF1-STAT1-Signalkaskade, die für die FLS-Chemokinsekretion wichtig ist.
mTOR Senses environmental cues to shape the fibroblast-like synoviocyte response to inflammation.
In diesem Beitrag zeigen wir, wie der mTOR-Stoffwechselweg die zelluläre Reaktion auf Entzündungsreize wie TNF erkennt und gestaltet. Außerdem zeigen wir, wie die metabolische Mikroumgebung die Reaktion des FLS auf Entzündungen über mTOR beeinflusst.
